

遗传性肾脏病是引起终末期肾病的常见原因,在需要肾脏替代治疗的终末期肾病患者中,几乎所有的儿童和至少10%的成人携带有肾脏相关基因缺陷。由于肾脏在耗氧量和线粒体丰度方面仅次于心脏,线粒体基因导致的功能障碍或者动力学缺陷被认为与遗传性肾脏病的发生发展密切相关。其中,分子机制研究较明确的线粒体基因变异仅有m.3243A>G(tRNAleu)和m.4291T>C(tRNAIle),分别导致局灶性阶段性肾小球硬化和远曲小管缺陷伴低镁血症,更多的mt-tRNA变异及其对肾脏疾病的致病贡献仍在很大程度上不清楚。
近日,浙江大学医学院附属儿童医院毛建华教授团队发现mt-tRNA基因上新的m.616T>C与家族性肾病密切相关,并通过功能实验探究了新变异的致病机制。该重磅研究成果“Heteroplasmic and homoplasmic m.616T>C in mitochondria tRNAPhe promote isolated chronic kidney disease and hyperuricemia”发表在顶级期刊 JCI insight(IF:8.3,中科院1区)。该研究中的3个家系全部由智因东方完成测序及分析,本文将对该研究进行简要介绍。
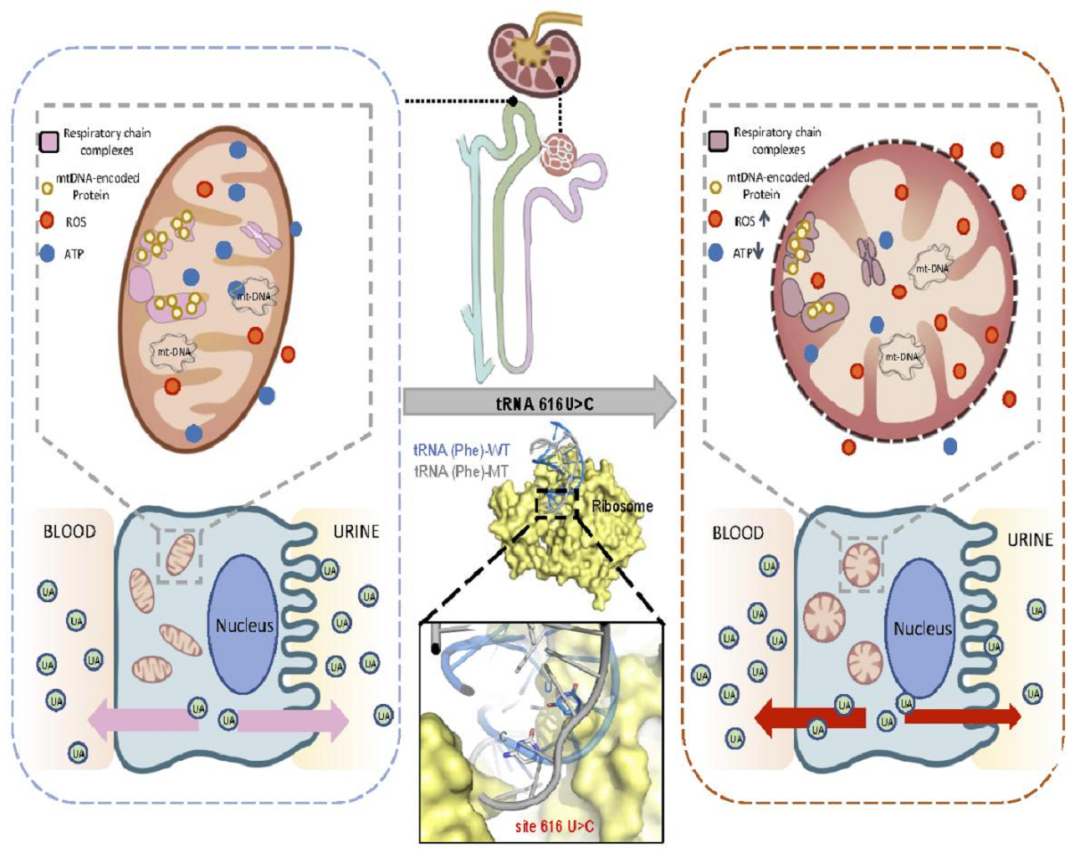
1 临床发现与思考
研究者首先发现了一个肾病大家系,4代人中有23名患者,他们的病史或临床诊断均为慢性肾脏病和高尿酸血症,没有血尿、蛋白尿、肾脏囊肿和神经系统等症状。该家族疾病的遗传特征呈现为母系遗传,患病男性的后代均没有患者。
研究者完善了该家系的线粒体基因测序,但在已知的致病位点上没有发现异常,而mt-tRNA基因上一个新的m.616T>C引起了关注,该变异很可能与该家族肾病有关。根据这一线索,研究者借助智因大数据继而发现了2个有相同线粒体基因变异的肾病家系,且临床表现与之前发现的家系极其相似。
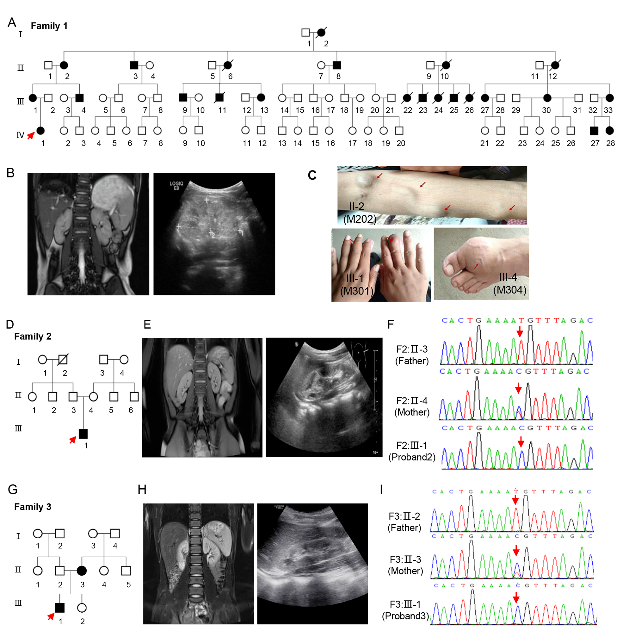
▲ 图1 本研究发现的3个m.616T>C家系
有了多个家系证据的支持,研究者坚定了对新发现的m.616T>C具有致病性的判断。为了进一步探究该变异的致病机制,随后设计了一系列的功能实验。
2 功能实验探究分子机制
• 透射电子显微镜结果
对患者肾小管上皮细胞和淋巴母细胞的透射电子显微镜观察发现,患者细胞内线粒体肿胀且自噬水平增加。
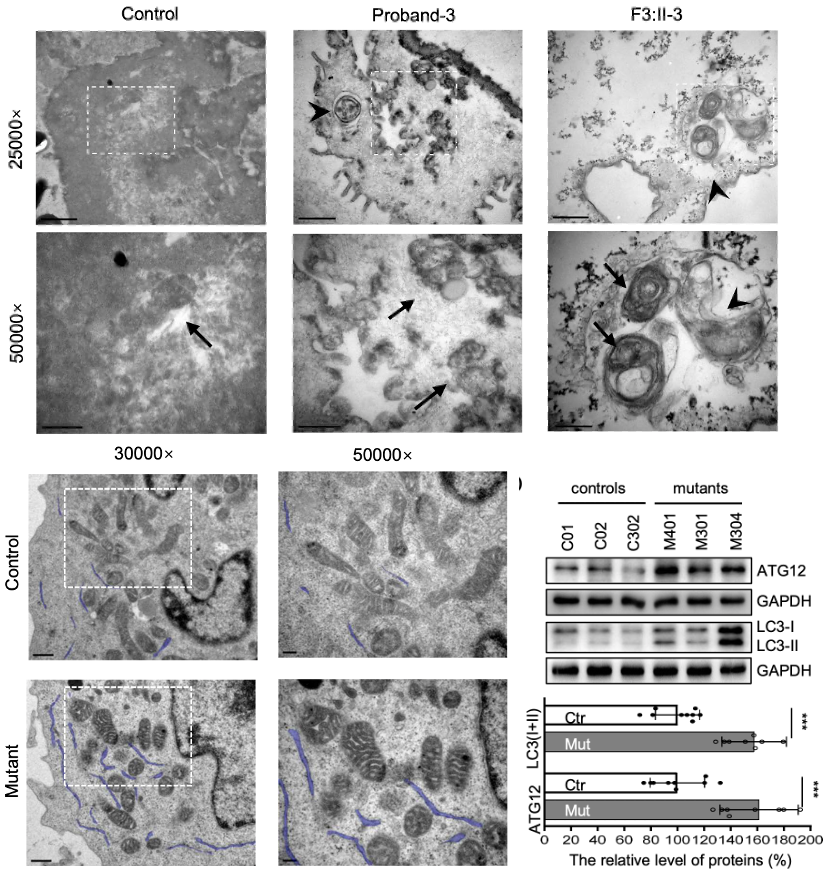
▲ 图2 上/下图均可见线粒体肿胀、变形,上图阔箭头示自噬体。右下Western Blot分析显示变异体自噬水平增高
• 构建m.616T>C淋巴细胞系
研究者通过患者肾组织活检和构建m.616T>C永生化淋巴细胞系,对线粒体功能和细胞功能进行了检测。结果显示,突变细胞系的线粒体ATP合成减少、膜电势降低和活性氧产生增加。
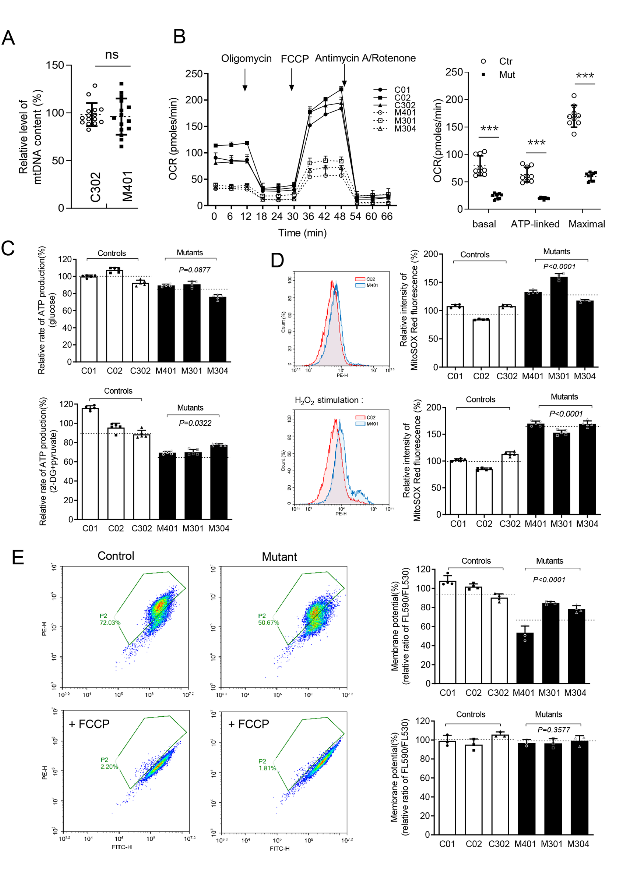
▲ 图3 m.616T>C突变体线粒体ATP合成减少、膜电势降低和活性氧产生增加
• 软件模拟分析
为了探究m.616T>C对编码tRNA的影响,研究者通过软件模拟分析(in-silico)和定量湿实验进行了探索:616T>C破坏该碱基对(31A-39U),可能造成tRNAPhe的结构不稳定。这种结构不稳定,通过实验被证实为Tm值下降和tRNAPhe迁移速率减慢。
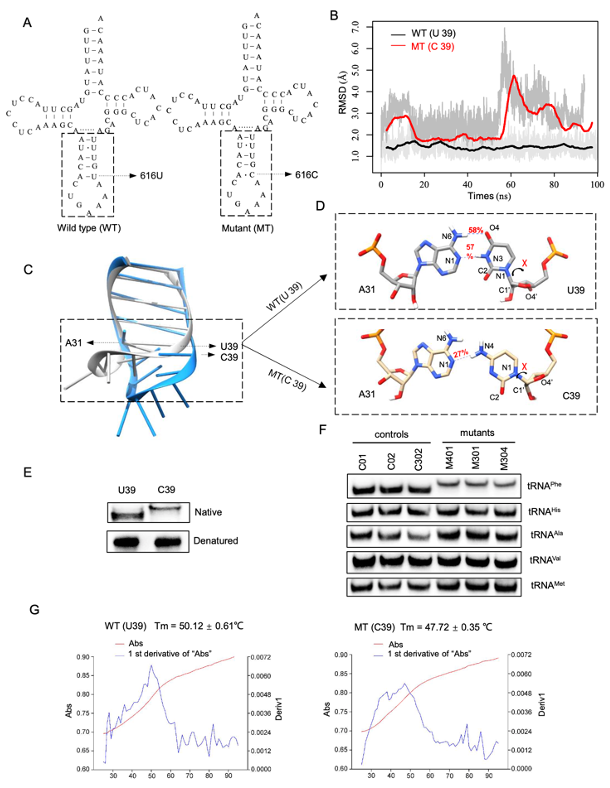
▲ 图4 苯丙氨酸转运RNA(tRNAPhe)m.616 T>C的软件模拟分析以及功能分析
• RNA定量分析
进一步在细胞系水平上,研究者验证了tRNAPhe稳态水平下降导致的后果。作为对比,作者将突变tRNAPhe与野生型tRNAPhe和其他种类tRNA进行对比,进行了RNA定量分析。结果发现突变tRNAPhe氨酰化水平升高,这导致了线粒体编码的多肽含量降低。
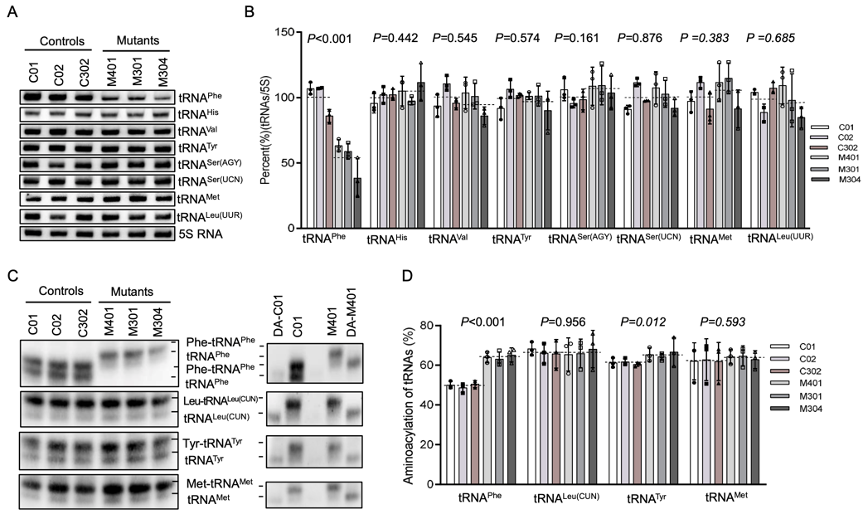
▲ 图5 细胞系水平上比较分析m.616T>C对tRNAPhe的功能影响
至此,研究团队首次证实了mt-tRNA基因616T>C影响线粒体tRNAPhe的结构和功能,从而导致氨酰化水平、稳态水平和蛋白翻译水平的异常,为线粒体基因相关遗传性肾脏病的发生机制和治疗策略提供了开拓性的研究思路。
值得注意的是,在一般临床工作中,发现鉴定新的线粒体致病变异并不常见和简单。除了常用的分析和流程,例如结构分析、Western Blot和Northern Blot等,该研究的关键在于首先发现m.616T>C与特殊肾病表型的关联性,并借助患者基因表型大数据发现更多家系证据进一步明确,进而才得以展开后续的因果关系分析。


