一、肿瘤基因时空全景测序,锁定neoantigen靶点
- 肿瘤突变众多,需要多靶点对治
低通量检测时代的技术局限带来的认识误区:
- 认为肿瘤是单个基因突变的结果,仅一个基因突变即可对肿瘤进行分子分型,如HER2阳性的乳腺癌,ALK阳性的肺癌,EGFR阳性的非小细胞肺癌等。这就好比盲人摸象,摸到什么就认为大象是什么,测到哪个基因的问题就说肿瘤是什么基因阳性,问题在于实验仅仅检测了这一个或少数的基因。
- 认为对肿瘤的治疗,只需要对治单一靶标就OK,但实际上并不OK,大多数靶向药一年左右就产生耐药。
高通量检测时代的认知颠覆
传统达尔文理论推测,肿瘤里的突变应该不多,但NGS揭示的事实是:一个肿瘤里的突变数量可以高达108之多。
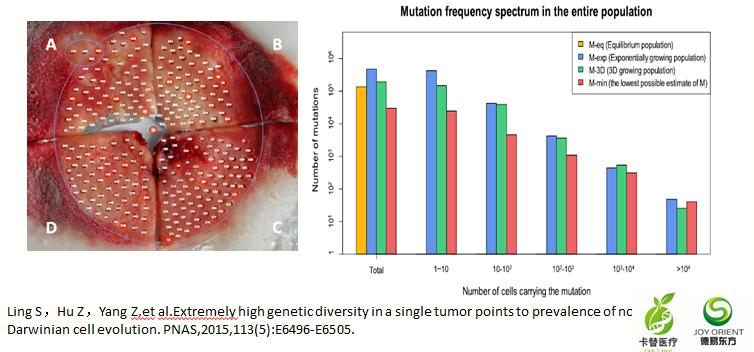
2015年《PNAS》刊登的研究表明,把一块肿瘤组织分成二百多个小碎片,分别进行高通量测序,结果显示每个碎片的突变情况都迥异,有的突变少些(成百上千),有的突变多达成千上万个!
因此肿瘤的基因组体现为突变谱,而非单一突变,其特点是:
- 静态看:体细胞突变多达成百上千甚至上万;
- 动态看:突变的丰度不断变化,新突变不断产生;
- 个性化:每个患者的neoantigen都各不相同;
单靶点治疗的局限
面对群狼(众多突变),只打一个能行?无论是靶向药,还是CAR-T,针对单靶点治疗,都会导致压力选择的结果,即“按下葫芦浮起瓢”——其他突变会大量滋生,导致耐药和复发。
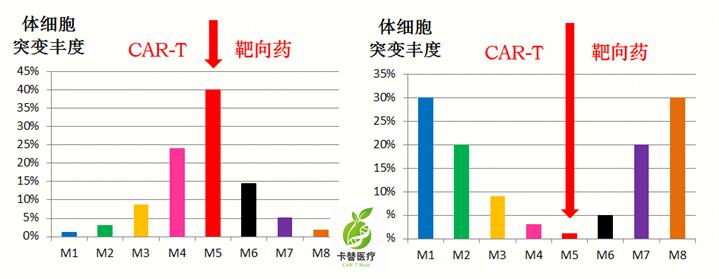
- 肿瘤基因时空全景测序,锁定neoantigen靶点
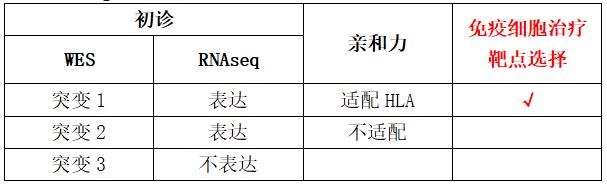
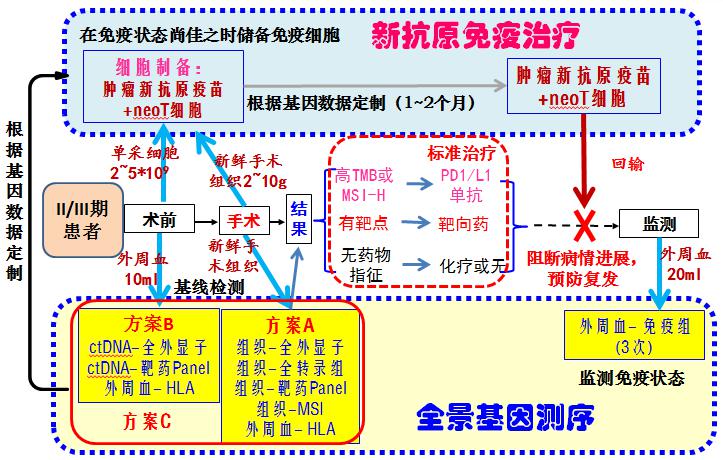
通过肿瘤新鲜组织全外显子组测序(WES)、肿瘤新鲜组织转录组测序(RNAseq)、HLA分型及抗原亲和力分析等项目,进行治疗靶标——新抗原(neoantigen)筛选。
二、靶向neoantigen的个体化多靶点免疫治疗
卡替医疗将高通量基因测序与多靶点DC疫苗构建技术、T细胞免疫治疗技术相结合,开创了中国靶向新抗原(neoantigen)的个体化多靶点免疫治疗的先河。
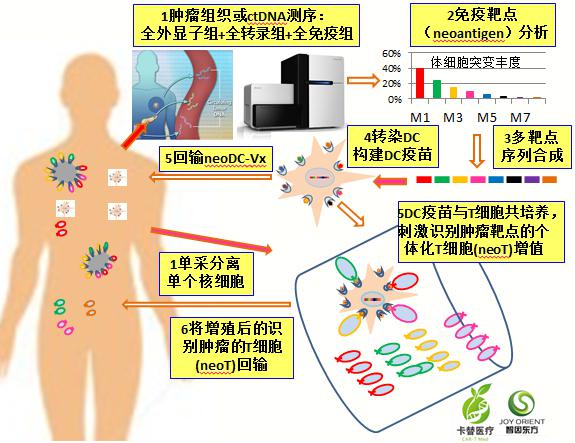
- 新抗原治疗的细胞制备流程
通过基因测序、突变亲和力分析筛选新抗原,并且合成新抗原序列,进一步转导DC得到负载新抗原的DC疫苗(neoDC-Vx),继而将neoVx激活外周血T细胞,得到新抗原反应性T细胞(neoT),将neoVx与neoT联合回输用于治疗(如下图)。
- 新抗原治疗的优势:
- 多靶点——群虎对抗群狼
- 高度安全性——对T细胞无加工,仅筛选
- 高度安全性——仅针对患者肿瘤突变,没有突变的正常细胞将不受攻击
- 高度广泛性——适用于各种肿瘤
- 动态适应性——动态诊治对抗动态克隆演变,可反复重复治疗流程
- 疗效持久——效用持久的解决方案
- 新抗原治疗的临床路径
NeoDC-Vx与neoT治疗可应用于II/III期患者术后复制,起到预防复发的效果。
三、成功案例
- 《Natrue》重磅:新抗原治疗应用于黑色素瘤接近100%CR!
2017年7月,《Nature》同期刊登两篇重磅研究,证明新抗原疗法的有效性。
美国丹娜法伯癌症研究院Catherine Wu教授团队:6名术后复发的黑色素瘤患者,经个体化多靶点DC疫苗治疗32个月后,肿瘤全部消失且无复发。
德国约翰内斯古腾堡大学医学中心的Ugur Sahin教授团队:13名晚期黑色素瘤患者,经个体化多靶点DC疫苗治疗26个月后,13人全部达到肿瘤全部消失且无复发。
- 卡替医疗的个体化多靶点免疫治疗案例
患者L,男,72岁,患血管免疫母细胞性T细胞淋巴瘤。4月份至5月份期间三次联合化疗后淋巴结较前缩小,但第三次化疗后出现肺部感染、呼吸衰竭,予抗感染、抗病毒、抗真菌等治疗后病情稳定,然而患者粒细胞持续下降。
8月接受卡替医疗的半相合(采用患者女儿外周血制备的)新抗原免疫治疗后一周,经CT监测淋巴结肿瘤全部消失,多次监测炎性因子均稳定,患者精神状态较前明显好转,由卧床不起转为可出外散步,白蛋白水平升至正常,粒细胞恢复正常。影像学提示原有淋巴结肿瘤均缩小至正常淋巴结范围,病人成功康复出院。

