一、肿瘤基因时空全景测序,锁定neoantigen靶点
- 单靶点治疗存在严重局限性
低通量检测时代的技术局限带来的认识误区:
- 认为肿瘤是单个基因突变的结果,仅一个基因突变即可对肿瘤进行分子分型,如HER2阳性的乳腺癌,ALK阳性的肺癌,EGFR阳性的非小细胞肺癌等。这就好比盲人摸象,摸到什么就认为大象是什么,测到哪个基因的问题就说肿瘤是什么基因阳性,问题在于实验仅仅检测了这一个或少数的基因。
- 认为对肿瘤的治疗,只需要对治单一靶标就OK,但实际上并不OK,大多数靶向药最终会耐药。
高通量检测时代的认知颠覆
传统达尔文理论推测,肿瘤里的突变应该不多,但NGS揭示的事实是:一个肿瘤里的突变数量可以高达108之多。
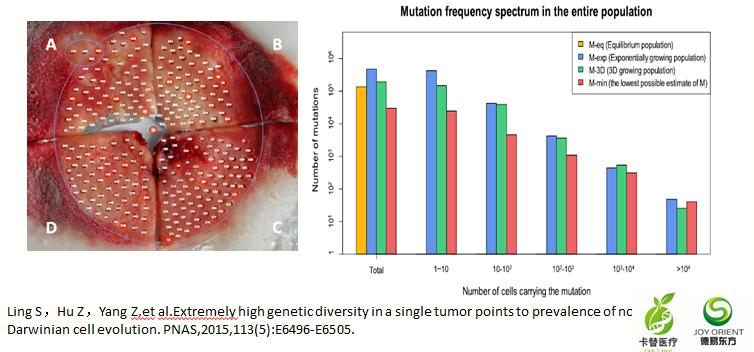
2015年《PNAS》刊登的研究表明,把一块肿瘤组织分成二百多个小碎片,分别进行高通量测序,结果显示每个碎片的突变情况都迥异,有的突变少些(成百上千),有的突变多达成千上万个!
因此肿瘤的基因组体现为突变谱,而非单一突变,其特点是:
- 静态看:体细胞突变多达成百上千甚至上万
- 动态看:突变的丰度不断变化,新突变不断产生
- 个性化:每个患者的neoantigen都各不相同
单靶点治疗的局限
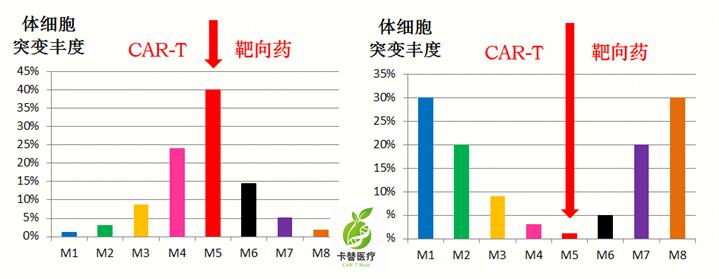
面对群狼(众多突变),只打一个能行?无论是靶向药,还是CAR-T,针对单靶点治疗,都会导致压力选择的结果,即“按下葫芦浮起瓢”——其他突变会大量滋生,导致耐药和复发。
肿瘤基因时空全景测序,锁定neoantigen靶点
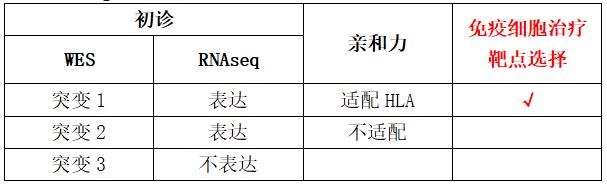
通过肿瘤新鲜组织全外显子组测序(WES)、肿瘤新鲜组织转录组测序(RNAseq)、HLA分型及抗原亲和力分析等项目,进行治疗靶标——新抗原(neoantigen)筛选。
二、靶向neoantigen的个体化多靶点免疫治疗
卡替医疗将高通量基因测序与多靶点neo疫苗构建技术、T细胞免疫治疗技术相结合,开创了中国靶向新抗原(neoantigen)的个体化多靶点免疫治疗的先河。
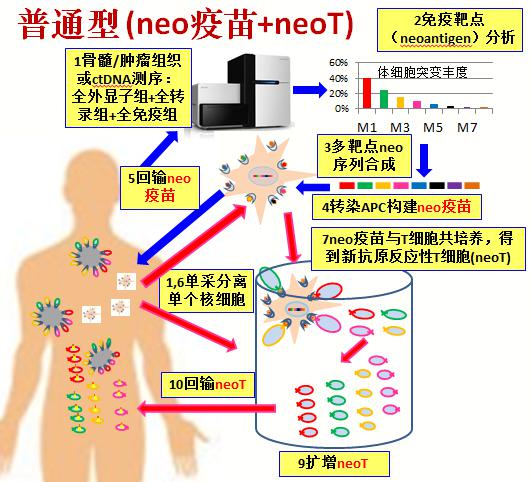
- 新抗原治疗的细胞制备流程
- 免疫组、全外显子组、转录组及HLA测序获得肿瘤BCR/TCR、肿瘤体细胞突变及融合基因的新抗原信息。
- 新抗原负载抗原提呈细胞,制备负载新抗原的细胞疫苗(neoVx)。
- neoVx刺激T细胞,获得新抗原反应性T细胞(neoT)。将neoVx与neoT联合回输用于治疗。或进一步对neoT进行单细胞测序,获得肿瘤特异性TCR序列,制备TCR-T细胞进行治疗。即为普通型新抗原治疗技术。
- 新抗原免疫治疗在血液肿瘤应用的意义
新抗原治疗可以解决CAR-T所无法解决的难题:
- 针对T细胞肿瘤患者的治疗
- 针对CAR-T无效或复发患者的治疗
- 与CAR-T联用以降低复发概率
- 血液肿瘤的新抗原的三类来源
- B/T系肿瘤细胞的BCR/TCR,来自免疫组测序(检测样本来自肿瘤组织或骨髓,或联合ctDNA);
- 肿瘤细胞的体细胞突变,来自全外显子组(检测样本来自肿瘤组织或骨髓,或联合ctDNA)及转录组测序(检测样本来自肿瘤组织或骨髓);
- 肿瘤细胞的融合基因,来自转录组测序(检测样本来自肿瘤组织或骨髓);

